Teilreaktionen von Redoxreaktionen erkennen
Redoxreaktionen aufstellen
Zuerst einmal eine Schrittfolge dazu:
und im Anschluss eine Übung
Elektronegativität
Viel Erfolg mit diesen Übungen…
Moodle-Datenbank: Einträge in Tabellen nummerieren
In der Vorlage der Listenansicht folgende Eintragungen vornehmen:
oberer Abschnitt:
<table>
<tr>
<th>Nr.</th>
<th>Spalte 2</th>
<th>Funktionen</th>
</tr>mittlerer Abschnitt:
<tr>
<td name="rowNr"> </td>
<td>[[Feld]]</td>
<td>##edit## ##more## ##approve## ##delete##</td>
</tr>unterer Abschnitt
</table>
In der Vorlage des JavaScripts folgende Eintragung vornehmen:
var rowCounter = 0;
function init(){
var numRows = document.getElementsByName("rowNr");
for (j=0; j<numRows.length; j++) {
rowCounter++;
numRows[j].innerHTML = rowCounter;
}
}
window.onload = init;
Tipp: Gegebenenfalls die Seite in der Listenansicht neu laden…
Moodle-Datenbank-Tipp: Zeilen in Listenansicht zählen
Wenn man die Datenbankeinträge in der Listenansicht als eine gemeinsame Tabelle erstellt hat, möchte man ggf. wissen, wie viele Zeilen vorhanden sind (ohne auf die Einzelansicht gehen zu müssen).
Dies ist mit etwas JavaScript und ein paar Ergänzungen im Code der Listen-Vorlage möglich:
Code

Damit der Code funktioniert, mussten diese Veränderungen (gelb hinterlegt) in der Vorlage für die Listenansicht vorgenommen werden:
Literaturverwaltung mit LaTeX
Dieses Thema ist schon recht komplex… Da ich online keine vernünftige grafische Darstellung der Zusammenhänge gefunden habe, habe ich mich nun selbst mal daran gemacht und einen ersten Versuch erstellt:
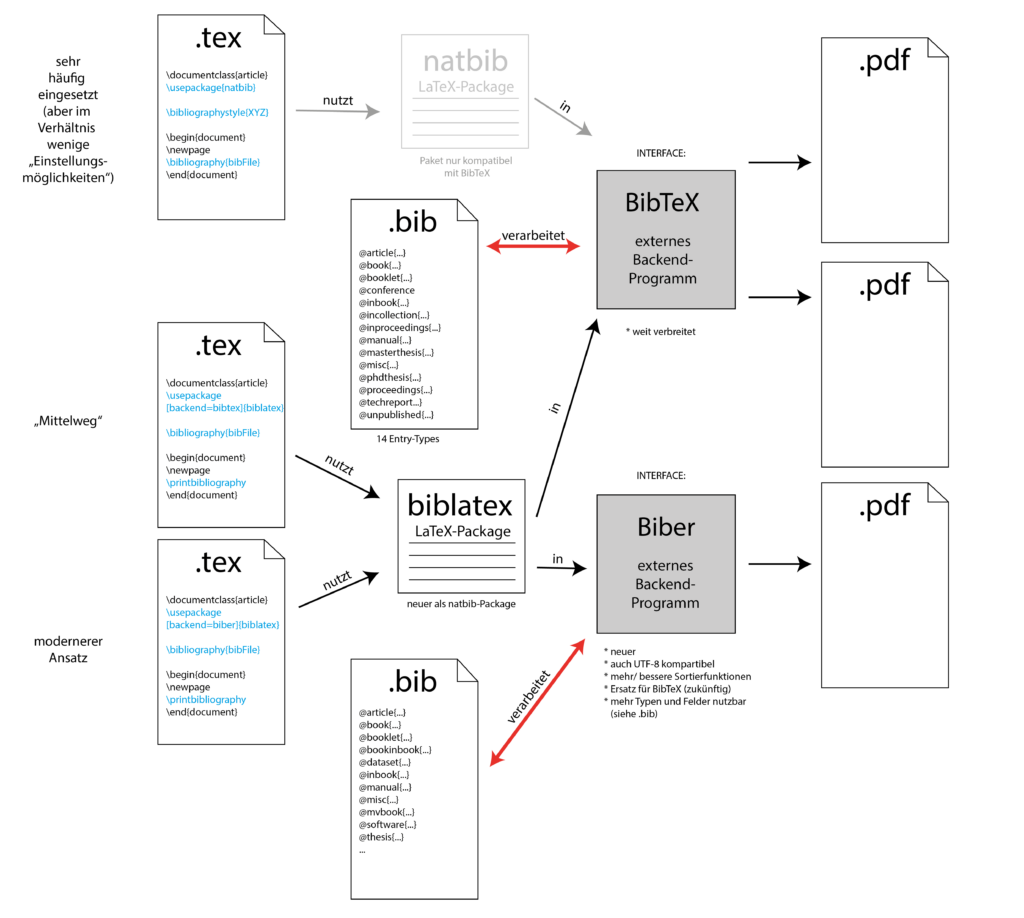
Über Hinweise zu Fehlern, sprachlichen Verbesserungen oder Tipps zur besseren Darstellung freue ich mich sehr!
Download:
Korrosion
Kohlenhydratchemie
Oxidationszahlen von Glucose
Um zu überprüfen, ob Glucose als Edukt (= Ausgangsstoff) bei einer Redoxreaktion teilnimmt, wird nach einer Veränderung der Oxidationszahlen geschaut.
Häufig ist die Summenformel dieser wichtigen organischen Verbindung (zum Beispiel aus dem Kontext Photosynthese) bekannt: C6H12O6.
Gibt man hier nach den bekannten Regeln die Oxidationszahlen für Wasserstoffatome mit +I und die für Sauerstoffatome mit -II an, so wird deutlich, dass die Kohlenstoffatome keine Ladung für das ungeladene Molekül mehr ausgleichen „müssen“ und somit die Oxidationszahl „Null“ (0) zugeordnet bekommen.
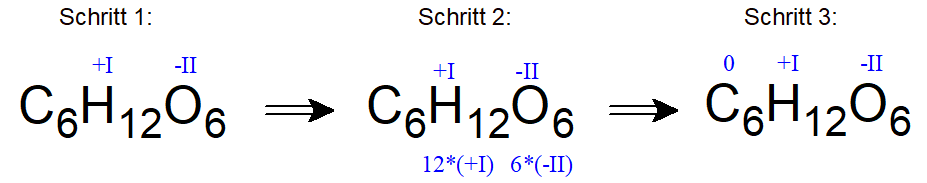
Das ist zwar auf das gesamte Molekül bezogen korrekt gerechnet, ABER tatsächlich erkennt man bei einer Lewis-Strukturformel, z.B. in der Fischer-Projektion (einer häufig bei Kohlenhydraten und Aminosäuren verwendeten Darstellungsform), dass tatsächlich drei verschiedene Oxidationszahlen für die einzelnen Kohlenstoffatome vorkommen:

Im links dargestellten Molekül erkennt man, dass bei dem Kohlenstoffatom der Aldehydgruppe (ganz oben) die Oxidationszahl „+I“ beträgt und das Kohlenstoffatom am Kettenende (unten) die Oxidationszahl „-I“ zugeordnet bekommt.
Sollte es nun zu einer Oxidation der Aldehydgruppe zu einer Carboxygruppe (R-COOH) kommen oder einer Reduktion zur Hydroxygruppe stattfinden, so ist dies durch eine Zunahme/ Abname der Oxidationszahl um zwei Einheiten aufzeigbar:
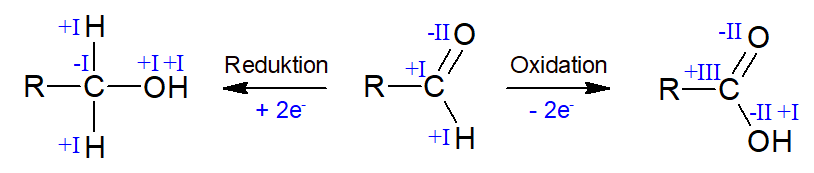
Bei einer Reduktion entsteht aus der Glucose das Sorbitol (ein sechswertiger Alkohol) und bei einer Oxidation die Gluconsäure (eine Polyhydroxycarbonsäure).
