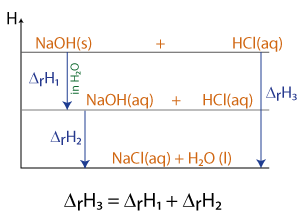
Enthalpiediagramm zur Veranschaulichung
Beim Lösen einer bestimmten Masse an festem Natriumhydroxid (z.B. in Form von Plätzchen) in Wasser wird Wärme frei. Es handelt sich um einen exothermen Prozess.
Reagiert nun diese entstandene alkalische Lösung (= Natronlauge) mit Salzsäure, so wird auch bei dieser Neutralisationsreaktion erneut Wärme freigesetzt.
Addiert man beide Enthalpien, so stellt man fest, dass dieser Wert sich mit dem gleicht, den man erhält, wenn die gleiche Masse an NaOH(s) mit der Salzsäure reagiert hätte.
Der Satz von Hess gilt (logischerweise) auch für den Gesamtprozess des Lösens und der Neutralisation wie auch die kombinierten Einzelvorgänge.
Die folgende Abbildung soll dies näher verdeutlichen:
Abhängigkeit der Gitterenergie bei Salzen
Die Gitterenergie (in kJ/mol) verschiedener Salze kann deutlich unterschiedliche Werte annehmen.
So beträgt die Gitterenergie UG von Lithiumiodid -742 kJ/mol und die von Aluminiumoxid -15.100 kJ/mol.
Doch wie kommen diese gewaltigen Energieunterschiede zwischen den verschiedenen Salzen zu stande?
Diese Zusammenhänge sind im Coulombschen Gesetz dargelegt:
Der Betrag dieser elektrischen Kraft (Coulomb-Kraft) ist proportional zum Produkt der beiden Ladungsmengen [ |F| ~ |q1 * q2| ] und umgekehrt proportional zum Quadrat des Abstandes der Ladungsmittelpunkte (man nimmt hierbei vereinfachend eine Kugelform an) [ |F|~ 1/r² ].

IUPAC-Nomenklatur von Tyrosin
Die Aminosäure Tyrosin enthält als charakteristischen Rest (orange umkreist) eine Methylengruppe (CH2), eine Phenylgruppe (6er-Ring) und eine daran gebundene Hydroxygruppe (OH) [Hinweis: in der Abbildung unten orange umkreist].
Allerdings folgt die Benennung nach IUPAC anderen Regeln…
Die Methylengruppe wird zum Stammnamen hinzugezählt, so dass Propansäure „entsteht“.
Am zweiten Kohlenstoffatom ist eine Aminogruppe gebunden, daher 2-Aminopropansäure (blau umkreist).
Am dritten Kohlenstoffatom ist nun die Phenylgruppe (lila umkreist; abgeleitet vom Benzolmolekül) mit daran gebundener Hydroxygruppe (grün umkreist) vorhanden.

Der systematische Name dieser proteinogenen alpha-Aminosäure lautet somit:
2-Amino-3-(4-hydroxyphenyl)-propansäure.
Woher kommt die „4“ von 4-hydroxyphenyl?
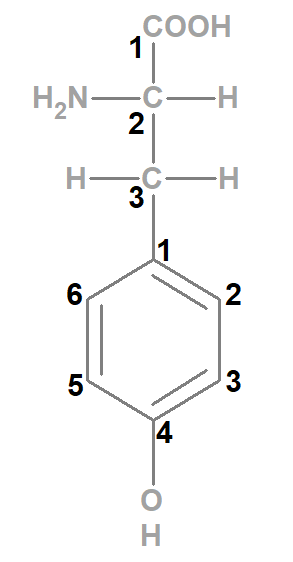
Damit man weiß, dass die „4“ die Angabe für die Position der Hydroxygruppe am Phenylrest ist, wird diese Seitenkette in Klammern gesetzt.
