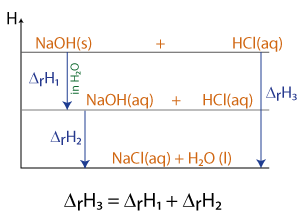
Beim Lösen einer bestimmten Masse an festem Natriumhydroxid (z.B. in Form von Plätzchen) in Wasser wird Wärme frei. Es handelt sich um einen exothermen Prozess.
Reagiert nun diese entstandene alkalische Lösung (= Natronlauge) mit Salzsäure, so wird auch bei dieser Neutralisationsreaktion erneut Wärme freigesetzt.
Addiert man beide Enthalpien, so stellt man fest, dass dieser Wert sich mit dem gleicht, den man erhält, wenn die gleiche Masse an NaOH(s) mit der Salzsäure reagiert hätte.
Der Satz von Hess gilt (logischerweise) auch für den Gesamtprozess des Lösens und der Neutralisation wie auch die kombinierten Einzelvorgänge.
Die folgende Abbildung soll dies näher verdeutlichen: