Zuerst einmal eine Schrittfolge dazu:
und im Anschluss eine Übung

Blog zu Themen der Naturwissenschaften
WordPress-Seite zur Biologie, Chemie und manchmal auch Physik
Zuerst einmal eine Schrittfolge dazu:
und im Anschluss eine Übung
Viel Erfolg mit diesen Übungen…
Um zu überprüfen, ob Glucose als Edukt (= Ausgangsstoff) bei einer Redoxreaktion teilnimmt, wird nach einer Veränderung der Oxidationszahlen geschaut.
Häufig ist die Summenformel dieser wichtigen organischen Verbindung (zum Beispiel aus dem Kontext Photosynthese) bekannt: C6H12O6.
Gibt man hier nach den bekannten Regeln die Oxidationszahlen für Wasserstoffatome mit +I und die für Sauerstoffatome mit -II an, so wird deutlich, dass die Kohlenstoffatome keine Ladung für das ungeladene Molekül mehr ausgleichen „müssen“ und somit die Oxidationszahl „Null“ (0) zugeordnet bekommen.
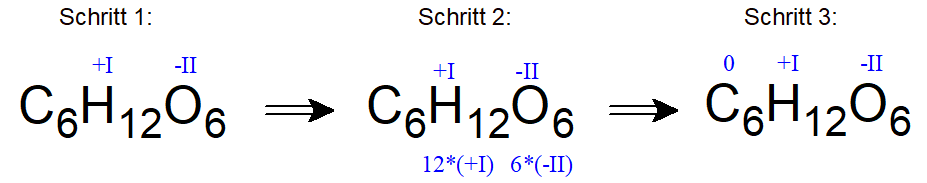
Das ist zwar auf das gesamte Molekül bezogen korrekt gerechnet, ABER tatsächlich erkennt man bei einer Lewis-Strukturformel, z.B. in der Fischer-Projektion (einer häufig bei Kohlenhydraten und Aminosäuren verwendeten Darstellungsform), dass tatsächlich drei verschiedene Oxidationszahlen für die einzelnen Kohlenstoffatome vorkommen:

Im links dargestellten Molekül erkennt man, dass bei dem Kohlenstoffatom der Aldehydgruppe (ganz oben) die Oxidationszahl „+I“ beträgt und das Kohlenstoffatom am Kettenende (unten) die Oxidationszahl „-I“ zugeordnet bekommt.
Sollte es nun zu einer Oxidation der Aldehydgruppe zu einer Carboxygruppe (R-COOH) kommen oder einer Reduktion zur Hydroxygruppe stattfinden, so ist dies durch eine Zunahme/ Abname der Oxidationszahl um zwei Einheiten aufzeigbar:
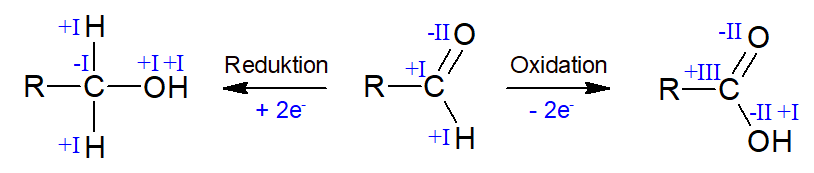
Bei einer Reduktion entsteht aus der Glucose das Sorbitol (ein sechswertiger Alkohol) und bei einer Oxidation die Gluconsäure (eine Polyhydroxycarbonsäure).
Aktuell scheint es (zumindest mit der aktuellsten Firefox-Version unter Windows 10) zu einem Problem bei der Erstellung von Gefährdungsbeurteilungen mit DEGINTU von der DGUV zu kommen…
Hier sind zwei Screenshots, die das Problem verdeutlichen:
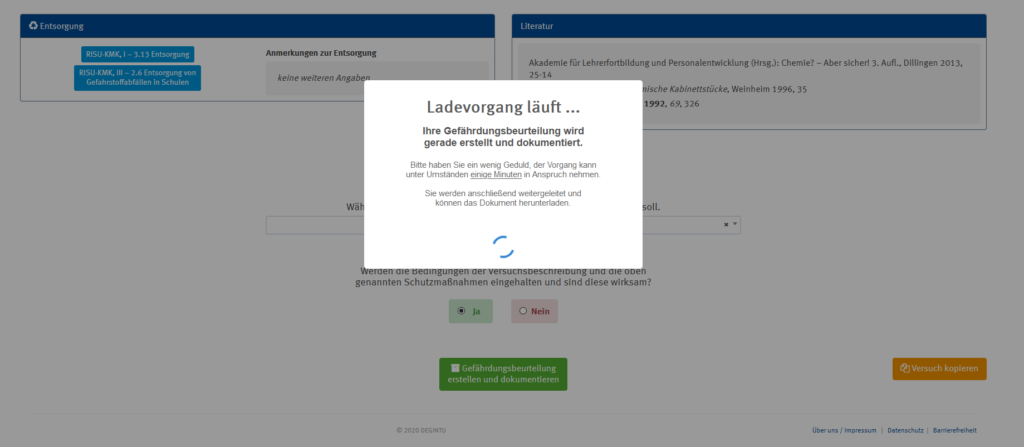

Die gewünschte PDF zum Ausdrucken wird somit leider nicht erstellt.
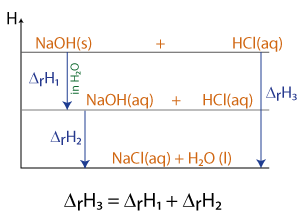
Beim Lösen einer bestimmten Masse an festem Natriumhydroxid (z.B. in Form von Plätzchen) in Wasser wird Wärme frei. Es handelt sich um einen exothermen Prozess.
Reagiert nun diese entstandene alkalische Lösung (= Natronlauge) mit Salzsäure, so wird auch bei dieser Neutralisationsreaktion erneut Wärme freigesetzt.
Addiert man beide Enthalpien, so stellt man fest, dass dieser Wert sich mit dem gleicht, den man erhält, wenn die gleiche Masse an NaOH(s) mit der Salzsäure reagiert hätte.
Der Satz von Hess gilt (logischerweise) auch für den Gesamtprozess des Lösens und der Neutralisation wie auch die kombinierten Einzelvorgänge.
Die folgende Abbildung soll dies näher verdeutlichen:
Die Gitterenergie (in kJ/mol) verschiedener Salze kann deutlich unterschiedliche Werte annehmen.
So beträgt die Gitterenergie UG von Lithiumiodid -742 kJ/mol und die von Aluminiumoxid -15.100 kJ/mol.
Doch wie kommen diese gewaltigen Energieunterschiede zwischen den verschiedenen Salzen zu stande?
Diese Zusammenhänge sind im Coulombschen Gesetz dargelegt:
Der Betrag dieser elektrischen Kraft (Coulomb-Kraft) ist proportional zum Produkt der beiden Ladungsmengen [ |F| ~ |q1 * q2| ] und umgekehrt proportional zum Quadrat des Abstandes der Ladungsmittelpunkte (man nimmt hierbei vereinfachend eine Kugelform an) [ |F|~ 1/r² ].

Die Aminosäure Tyrosin enthält als charakteristischen Rest (orange umkreist) eine Methylengruppe (CH2), eine Phenylgruppe (6er-Ring) und eine daran gebundene Hydroxygruppe (OH) [Hinweis: in der Abbildung unten orange umkreist].
Allerdings folgt die Benennung nach IUPAC anderen Regeln…
Die Methylengruppe wird zum Stammnamen hinzugezählt, so dass Propansäure „entsteht“.
Am zweiten Kohlenstoffatom ist eine Aminogruppe gebunden, daher 2-Aminopropansäure (blau umkreist).
Am dritten Kohlenstoffatom ist nun die Phenylgruppe (lila umkreist; abgeleitet vom Benzolmolekül) mit daran gebundener Hydroxygruppe (grün umkreist) vorhanden.

Der systematische Name dieser proteinogenen alpha-Aminosäure lautet somit:
2-Amino-3-(4-hydroxyphenyl)-propansäure.
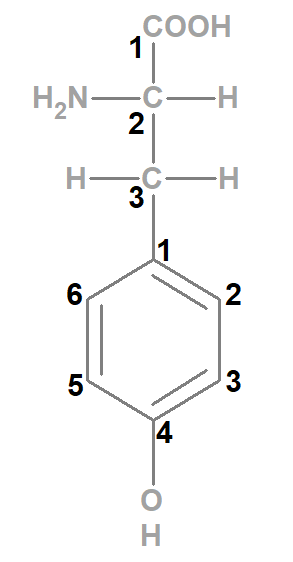
Damit man weiß, dass die „4“ die Angabe für die Position der Hydroxygruppe am Phenylrest ist, wird diese Seitenkette in Klammern gesetzt.
Über Geschmack lässt sich ja bekanntlich nicht streiten, aber dieses Ergebnis einer Google-Recherche hat mich doch überrascht:
Ich bin bislang zumeist sehr angetan von den Lexikoneinträgen bei Spektrum – vielleicht sollte man sich dort nun verstärkt um die Kategorisierung kümmern 🙂
Eigentlich war ich auf der Suche nach der Zusammensetzung von Schweiß, um die positive Ninhydrin-Reaktion (als Nachweis der Aminosäuren) mit mehr Informationen hinterlegen zu können, aber jetzt habe ich erstmal Hunger bekommen…
Vielleicht gibt es auch Aussagen zum Nährwert? Hmmmmm…