Um zu überprüfen, ob Glucose als Edukt (= Ausgangsstoff) bei einer Redoxreaktion teilnimmt, wird nach einer Veränderung der Oxidationszahlen geschaut.
Häufig ist die Summenformel dieser wichtigen organischen Verbindung (zum Beispiel aus dem Kontext Photosynthese) bekannt: C6H12O6.
Gibt man hier nach den bekannten Regeln die Oxidationszahlen für Wasserstoffatome mit +I und die für Sauerstoffatome mit -II an, so wird deutlich, dass die Kohlenstoffatome keine Ladung für das ungeladene Molekül mehr ausgleichen „müssen“ und somit die Oxidationszahl „Null“ (0) zugeordnet bekommen.
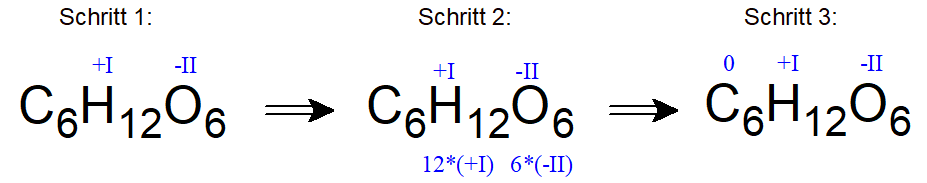
Das ist zwar auf das gesamte Molekül bezogen korrekt gerechnet, ABER tatsächlich erkennt man bei einer Lewis-Strukturformel, z.B. in der Fischer-Projektion (einer häufig bei Kohlenhydraten und Aminosäuren verwendeten Darstellungsform), dass tatsächlich drei verschiedene Oxidationszahlen für die einzelnen Kohlenstoffatome vorkommen:

Im links dargestellten Molekül erkennt man, dass bei dem Kohlenstoffatom der Aldehydgruppe (ganz oben) die Oxidationszahl „+I“ beträgt und das Kohlenstoffatom am Kettenende (unten) die Oxidationszahl „-I“ zugeordnet bekommt.
Sollte es nun zu einer Oxidation der Aldehydgruppe zu einer Carboxygruppe (R-COOH) kommen oder einer Reduktion zur Hydroxygruppe stattfinden, so ist dies durch eine Zunahme/ Abname der Oxidationszahl um zwei Einheiten aufzeigbar:
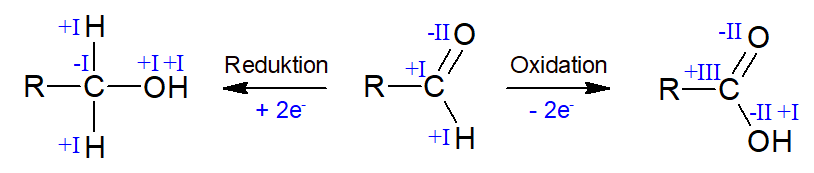
Bei einer Reduktion entsteht aus der Glucose das Sorbitol (ein sechswertiger Alkohol) und bei einer Oxidation die Gluconsäure (eine Polyhydroxycarbonsäure).
